GANGLIOGLIOMA ANAPLASTICO TRATTATO CON BEVACIZUMAB
Il ganglioglioma (gr. I sec. WHO 2007) è un tumore cerebrale primitivo raro rappresentando solo lo 0,4% di tutti i tumori del SNC. L'esordio avviene tipicamente in età giovanile con crisi epilettiche spesso resistenti alla terapia farmacologica.
Nella maggior parte dei casi, questo tumore mostra un comportamento clinico benigno e l'asportazione chirurgica è spesso una terapia sufficiente. L'evoluzione verso un ganglioglioma anaplastico (gr. III sec. WHO) è possibile anche se rara.
Il trattamento standard del ganglioglioma anaplastico è rappresentato dall'asportazione chirurgica, la più ampia possibile, seguita dalla radioterapia con una dose totale di 60 Gy. Rimane non definito il successivo trattamento in caso di progressione o recidiva.
Temozolomide è un agente alchilante la cui attività è stata ampiamente dimostrata nei tumori gliali, mentre il bevacizumab è un anti-angiogenetico diretto contro VEGF-A la cui attività è stata dimostrata nel glioblastoma. Sono riportarti solo casi aneddotici circa l'utilizzo di temozolomide nel ganglioglioma anaplastico, mentre non vi sono dati in letteratura circa l'utilizzo del bevacizumab.
Caso clinico
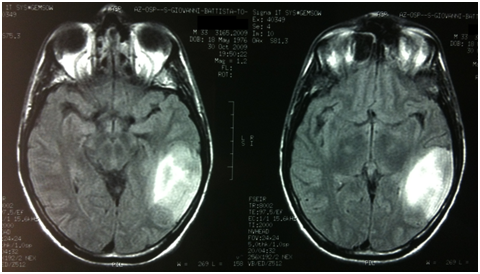
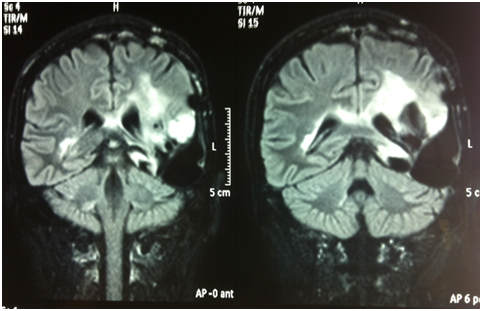
Descriviamo il caso di un paziente maschio di 33 anni che nell'ottobre 2009 presentava la comparsa di episodi di ?speech arrest? in corso di ipertermia. Veniva pertanto sottoposto a diversi accertamenti (TC encefalo, RM encefalo con spettroscopia, rachicentesi) che dimostravano due aree di alterato segnale localizzate in sede temporo-parietale e parietale sinistra compatibili con una lesione neoplastica. Il paziente veniva quindi sottoposto ad asportazione chirurgica in due tempi delle due lesioni nel gennaio e nel maggio 2010. Gli esami istologici deponevano per ganglioglioma gr. I WHO (Ki67: 7%, 19q deleto, promoter MGMT non metilato, IDH1 mutato). Non si verificavano ulteriori crisi epilettiche dopo la chirurgia.
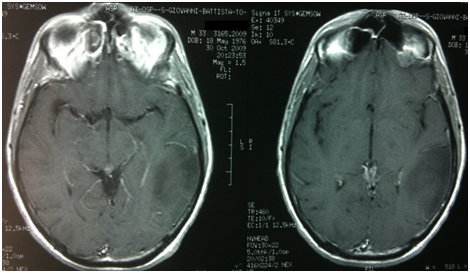
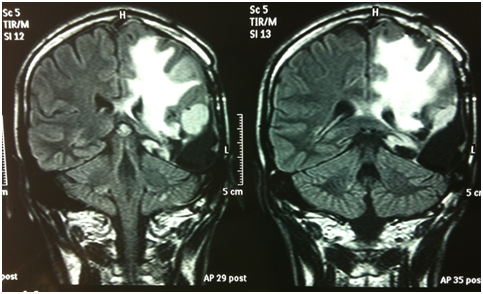
Il paziente veniva quindi sottoposto ad un attento follow up clinico-radiologico fino a dicembre 2010 quando si verificava una nuova progressione clinico-radiologica con un enhancement a livello parietale. Reintervento chirurgico nel marzo 2011 con ampia asportazione della recidiva di malattia. Esame istologico: ganglioglioma anaplastico gr. III WHO (Ki67% 5-6%, IDH1 mutato). Seguiva trattamento radioterapico conformazionale ad intensità modulata con IGRT (DFT 60 Gy/30 frazioni) terminato nel giugno 2011.
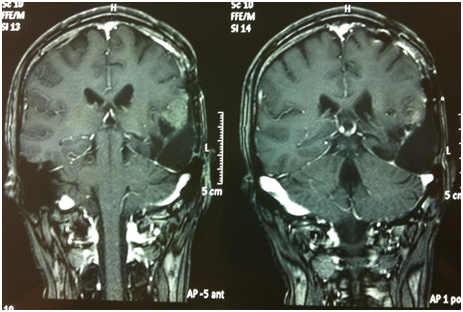
Al controllo RM di settembre 2011 si osservava un iniziale incremento del residuo di malattia, veniva pertanto iniziato un trattamento con temozolomide standard. Dopo 6 cicli di terapia (marzo 2012), il paziente mostrava un peggioramento dal punto di vista neurologico (aumento della frequenza critica, comparsa di deficit stenico facio-brachio-crurale destro) e la nuova RM encefalo mostrava una nuova PD enhancing. Veniva quindi intrapreso un trattamento di induzione con fotemustina (FTM) + bevacizumab (giorno 1: FTM 75 mg/m2 + bevacizumab 10 mg/kg; giorno 8: FTM 75 mg/m2; giorno 15: bevacizumab 10 mg/kg). Al termine della fase di induzione, il paziente si presentava migliorato dal punto di vista clinico (regredita emiparesi destra) e dal punto di vista radiologico. La RM dimostrava una minor response (MR) in T2/FLAIR e in T1 con mezzo di contrasto. Le risposte sono state valutate secondo i criteri RANO (van den Bent, 2011). A causa di una modesta tossicità ematologica, si decideva di continuare la terapia di mantenimento con il solo bevacizumab (10 mg/kg ogni 2 settimane).
A giugno 2012, dopo aver completato 3 somministrazioni di mantenimento di bevacizumab, si verificava una nuova progressione clinico-radiologica. In considerazione dei dati riportati in letteratura (Schindler et al, 2011), si richiedeva la ricerca della mutazione V600E di BRAF sui campioni tumorali per un'eventuale terapia con vemurafenib, ma l'esame risultava negativo. Nelle settimane successive, ulteriore peggioramento clinico. Il paziente è deceduto a cinque mesi dall'inizio del trattamento con bevacizumab e a circa 3 anni dalla diagnosi.
Conclusioni
Dal punto di vista clinico, si tratta del primo caso di ganglioglioma anaplastico trattato con bevacizumab ottenendo una risposta clinico-radiologica, seppure di breve durata. Riguardo, invece, il ruolo dei fattori biomolecolari, questo caso presenta diversi aspetti interessanti: l'andamento clinico sembrerebbe confermare l'impatto negativo della mutazione di IDH1 in questo istotipo (Horbinski et al., 2011), mentre la ricerca della mutazione V600E di BRAF (riportata in letteratura, ma assente nel nostro caso) potrebbe essere rilevante alla luce della disponibilità di terapie specifiche come il vemurafenib.
Bibliografia
- Schindler G, Capper D, Meyer J, Janzarik W, Omran H, Herold-Mende C, et al. Analysis of BRAF V600E mutation in 1,320 nervous system tumors reveals high mutation frequencies in pleomorphic xanthoastrocytoma, ganglioglioma and extra-cerebellar pilocytic astrocytoma. Acta Neuropathol. 2011;121:397-405.
- Horbinski C, Kofler J, Yeaney G, Camelo-Piragua S, Venneti S, Louis DN, et al. Isocitrate dehydrogenase 1 analysis differentiates gangliogliomas from infiltrative gliomas. Brain Pathol. 2011;21:564-74.
- Selvanathan SK, Hammouche S, Salminen HJ, Jenkinson MD. Outcome and prognostic features in anaplastic ganglioglioma: analysis of cases from the SEER database. J Neurooncol. 2011;105:539-45.
- Compton JJ, Issa Laack NN, Eckel LJ, Schomas DA, Giannini C, Meyer FB. Long-term outcomes for low-grade intracranial ganglioglioma: 30-year experience from the Mayo Clinic. J Neurosurg. 2012 [Epub ahead of print].